Ein Berner im Wettlauf gegen die Parasiten
Er ist resistenten Parasiten auf der Spur: Der Zellbiologe Pascal Mäser schafft mit seiner Forschung Grundlagen, um neue wirksame Medikamente gegen die Schlafkrankheit und Magenwurm-Infektionen zu finden. Er erhielt den Theodor-Kocher-Preis 2008 und erläuterte die komplexen Prozesse der Resistenzbildung in einem Vortrag.
Im Endstadium kommt der Schlaf. Neben schweren neurologischen Symptomen ist andauernde Apathie ein Merkmal der Krankheit - sie hat ihr schliesslich den Namen gegeben: der Schlafkrankheit, die durch einzellige Parasiten, die Trypanosomen, verursacht wird. In Afrika werden jährlich bis zu einer halben Million Menschen durch den Stich infizierter Tsetse-Fliegen mit dem Parasiten angesteckt, ohne Behandlung sterben sie. Während eine Infektion anfänglich meist ohne Komplikationen behandelt werden kann, bleibt für schwer Erkrankte nur eine Chemotherapie, die massive Nebenwirkungen nach sich zieht, wie der Berner Zellbiologie Pascal Mäser erklärt. Überwinden die Krankheitserreger nämlich die Blut-Hirn-Schranke und gelangen ins Zentralnervensystem, helfen nur noch toxische Arzneimittel wie etwa das Melarsoprol, ein giftiges Arsenderivat. Wenn überhaupt – denn gegen dieses Medikament haben sich gemäss Mäser Resistenzen gebildet; die Arznei wird wirkungslos. Der Forscher hat die zugrundeliegenden Mutationen in den Genen der Erreger beschrieben.
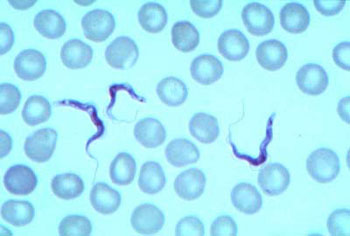
Zwischen den Blutzellen gut zu erkennen: die fadenförmigen Parasiten Trypanosoma brucei. (Bild:WHO/zvg)
Zusammen mit Forschungspartnern aus Uganda und Europa legte Pascal Mäser die Grundlage zur epidemiologischen Erfassung der resistenten Trypanosomen-Stämme in Afrika. Mäser, der eine Förderprofessur am Institut für Zellbiologie innehat, hat den Theodor-Kocher-Preis 2008 der Uni Bern erhalten – für seine vielfältigen Kooperationsprojekte auf nationaler und internationaler Ebene (siehe Kasten).
Die fatalen Resistenzen
Resistenzen gegen Medikamente sind gefürchtet, «kommen aber überall in der Medizin vor», erklärt Pascal Mäser: Denn wo Arzneimittel eingesetzt würden - sei es bei Krebs, Tuberkulose oder HIV - entwickelten sich immer auch einige resistente Erreger, die durch den Zufall der Natur genetisch leicht anders, also mutiert, sind. Dadurch erhalten sie von der Norm abweichende Zellstrukturen, welche das Medikament nicht angreifen kann. Die Folge solcher genetischer Mutationen ist schnell klar: Während die ursprünglichen Erreger abgetötet werden, kann sich der mutierte, resistent gewordene Organismus schnell und ungehindert vermehren. «Das ist Evolution - man kann sie nicht verhindern», so Mäser.
Die veränderte Schleuse
Für die Resistenz gegen Melarsoprol ist eine veränderte Struktur auf der Zelloberfläche des Erregers Trypanosoma brucei verantwortlich: der so genannte Transporter P2, eine Schleuse, welche normalerweise gewisse Bausteine für die Gene, die Nukleinsäuren, in die Zellen passieren lässt. Die 3-D-Struktur des Medikaments Melarsoprol ist diesen Nukleinsäuren ähnlich, und infolge dessen gelangt das Medikament über diese Schleuse in die nicht resistenten Erreger hinein. Die resistenten Trypanosomen weisen auf dem Gen, welche die Struktur von P2 definiert, jedoch Mutationen auf, wie Mäser herausgefunden hat. Die Folge: Das Medikament wird nicht mehr aufgenommen. Mäser konnte nun mit Enok Matovu, seinem Forscherkollegen von der Makerere University in Uganda, nachweisen, dass sich die Resistenzen, die in der Natur vorkommen und jene aus dem Labor ähnlich sind. «Das Therapieversagen mit Melarsoprol hängt mit diesen Mutationen zusammen», fasst der Zellbiologie zusammen. Enok Matovu, der in Bern doktoriert hat, erhielt kürzlich in diesem Zusammenhang den «Royal Society Pfizer Award».
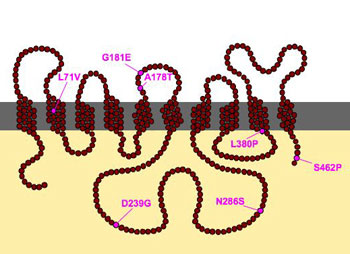
Genetische Mutationen lassen die Struktur der Schleuse P2 (Bild) an verschiedenen Orten verändern: Das Medikament Melarsoprol wird nicht mehr aufgenommen. (Grafik: zvg)
Die vernachlässigte Krankheit aus den Tropen
Für die anstehende Forschung heisst das: «Es müssen neue Medikamente entwickelt werden, die nicht über die Schleuse P2 in die Erreger gelangen, sondern über andere Transportwege.» Bis dahin können die Ärzte in Afrika zur Therapie der Schlafkrankheit noch auf ein zweites Medikament ausweichen – Eflornithin, ein Wirkstoff, der lange Zeit nicht grossflächig eingesetzt wurde. Pascal Mäser erklärt: «Die Schlafkrankheit ist noch immer eine vernächlässigte Krankheit der Tropen, da sich mit deren Heilung kaum Geld verdienen lässt.»
Zur Person

Prof. Dr. Pascal Mäser forscht mit seiner Arbeitsgruppe für molekulare Parasitologie am Institut für Zellbiologie der Uni Bern. Neben der Forschung an der Medikamenten-Resistenz bei der Schlafkrankheit, arbeitet Mäser auch neue Strategien zur medikamentösen Therapie von Magenwurm- Infektionen bei Nutztieren aus. Im Bereich der Gen-Forschung vergleicht der Molekularbiologe Genome von Parasiten auf Unterschiede und Gemeinsamkeiten. Die vergleichende Genomik bei Parasit und Wirt kann schliesslich zu grundlegenden Ansätzen in der Entwicklung von Medikamenten führen. In allen Bereichen hat Pascal Mäser wichtige Netzwerke mit internationalen Forschungspartnern sowie mit der Industrie aufgebaut.